注册送38元的游戏网站
大多数肽的合成是通过采用Fmoc或Boc保护方法的固相肽合成来实现的,然而在使用Fmoc-OSu时,由于二肽(或三肽)和β-丙氨酰胺杂质的形成,在氨基酸中未受保护的N引入Fmoc似乎具有挑战性。在此介绍一种基于肟的衍生物Fmoc-Amox合成Fmoc-Gly-OH的有效方法,且没有任何副反应。Fmoc-Amox价格低廉,并且Amox在反应后可以很容易地去除,从而提供不含任何有害杂质或污染物(主要是二肽或Amox本身)的纯Fmoc-Gly-OH,这一点可以从高效液相色谱和核磁共振得到论证。
1963年,Merrifield描述了一种全新的化学合成概念,市场上有一些药物的活性成分(API)是TIDES(寡核苷酸和肽治疗剂),含有多达30-40个单体,这些单体是使用Merrifield首次描述的固相方法生产的。虽然一开始固相肽合成(SPPS)方法在某种程度上受到了他欧洲同事的质疑,但目前此方法已经广泛应用于合成研究及生产。
从命名可以看出,所有氨基酸至少有两个官能团:一个羧酸和一个氨基。如果氨基酸C末端羧酸的活性被不溶性高分子基团掩盖、氨基被临时保护起来,再逐步连续的参与反应,也包括脱除氨基的保护基团,然后与下一个N被保护的氨基酸进行偶联。然而,在三官能团氨基酸的情况下,侧链则被永久(或半永久)保护基团所保护。早些年,Merrifield使用苄基 (Bn) 进行长期保护,使用叔丁氧基羰基 (Boc)作为临时保护基团,但是Boc和Bn都可以在酸性条件下分解:三氟乙酸(TFA)脱Boc、强酸如HF或三氟甲磺酸(TFMSA)水解Bn。在70年代,同样提出过Boc保护基团的Carpino,通过提出芴基甲氧羰基(Fmoc)作为临时保护氨基的基团,彻底改变了肽化学领域,即可以使用碱脱除N保护基团,因而与Boc基团正交。此外,欧洲的Sheppard和Atherton,与美国的Chang和 Meienhofer同时开发了Fmoc/t-Bu方法,反应用TFA溶液处理后释放出肽。该方法的实施标志着肽合成的“平民化”,因为Boc/Bn方法的使用需要训练有素的化学工作者和特殊设备,而通过Fmoc/t-Bu方法,其他生物学实验室也能够合成肽。此外,该方法已实现了生产公斤级肽。
最初商业化的Fmoc-氨基酸是用Schotten-Baumann方法合成:氨基酸与Fmoc-Cl在碱性条件下反应(图1A)。80年代早期,Ashish小组和Bachem、Goodman指出了大多数商业化Fmoc-氨基酸中包含二肽和三肽,这些杂质来自Fmoc-Cl的高反应性,它也可以与要保护的氨基酸的羧基反应生成酸酐,酸酐又可以与另一个氨基酸分子的胺末端反应,导致形成二肽。机制如图1B所示。
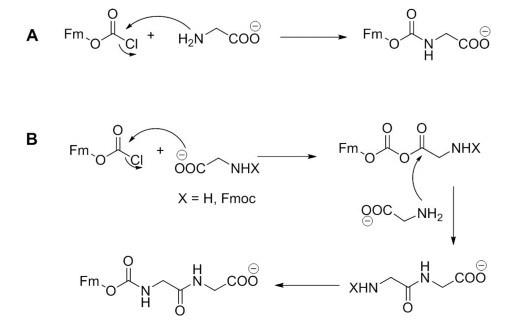
图1 氨基酸的Fmoc保护
A. Fmoc保护机制
B. 在氨基酸保护过程中形成受保护二肽的机制
考虑到即使是很小比例的杂质也会导致收率和纯度下降,因此双方共同得出了避免使用 Fmoc-Cl的结论。由于这些副反应与离去基团的质量有关,Ashish小组建议使用Fmoc-N3,同样Carpino 和Han在他们的论文中也有提到此观点。Ashish小组提出了用Fmoc-Cl和叠氮化钠合成Fmoc-N3,为了避免Fmoc-N3制备和存储的危险性,现做现用,该方法合成的Fmoc-氨基酸具有较高纯度。Verlander等人通过筛选不同的离去基团,建议使用Fmoc-OSU,与此同时,Bolin等人建议使用甲硅烷基化试剂保护羧基。多年后,Barlos等人提出了从Trt-Cl制备Trt-氨基酸的方法,以避免Trt酯类杂质的生成。后来,Suresh等人提出在活化锌粉存在下用Fmoc-Cl制备Fmoc-氨基酸,此方法允许在中性条件下进行。
然而,长期以来最常用的Fmoc-氨基酸合成方法是Fmoc-OSu(或 NHS),当Hlebowicz等人对Fmoc-Cl制备Fmoc-氨基酸提出质疑时,该方法也受到了质疑。Bachem Europe的研究表明,使用Fmoc-OSu制备的Fmoc-AA-OH中含有Fmoc-β-Ala-OH和Fmoc-β-Ala-AA-OH,这两个杂质是在OSu攻击一个羰基后通过Lossen重排形成的(图2)。
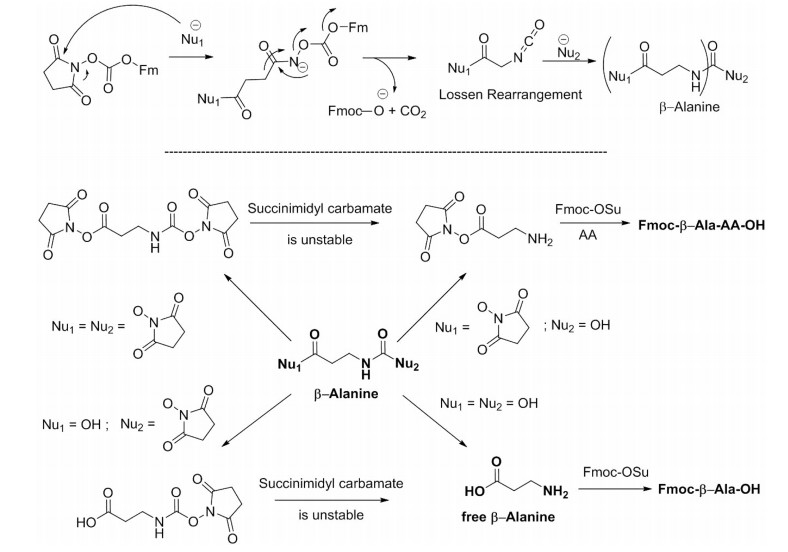
图2 β-丙氨酰胺通过Lossen重排的形成机制
这些发现再次激发了开发新试剂或安全引入Fmoc基团方法的研究热情。表1列出了用于保护氨基酸的不同Fmoc衍生物及其用于制备Fmoc-Gly-OH的结果,虽然这种反应可以用于所有氨基酸的保护,但Gly更明显,因为它的低位阻有利于高效率的聚合。这些引入Fmoc的衍生物应具有两个关键特征:(i)无特殊高反应性,避免低聚肽的形成;(ii)离去基团通常是被氨基酸取代的羟基化合物,在处理过程中相对更容易去除。因此,Ashish小组首先提出了 Fmoc-2-巯基苯并咪唑,它合成的Fmoc衍生物中低聚肽较少(表1,#4)。然而,反应中释放的副产物2-MBT溶解度差,需要用有机溶剂洗涤才能完全去除,而Fmoc-氨基酸在有机溶剂中也有一定的溶解度,因此不利于最终产率。Verlander等人遇到了类似的问题,当使用(多)氯苯基衍生物时,有机溶剂醇污染了最终产品,导致总收率低(4-30%)。
其他琥珀酰亚胺的衍生物,例如邻苯二甲酰亚胺、降冰片烯基(它是由降冰片烯衍生的自由基)和相应的螺环类似物、六元衍生物等,也进行了分析,但并不具有显著优势(表1,#5-7)。同时,当降冰片烯基与EDC结合用于水中的固相肽合成 (SPPS) 时,检测到了β-丙氨酸的形成。为了克服使用琥珀酰亚胺衍生物导致β-丙氨酰胺残基嵌入问题,Najera等人提出了一种聚合物形式的试剂,最终β-丙氨酰胺污染物是固定在聚合物载体上的,但这种方法限制了制备少量保护氨基酸的使用。
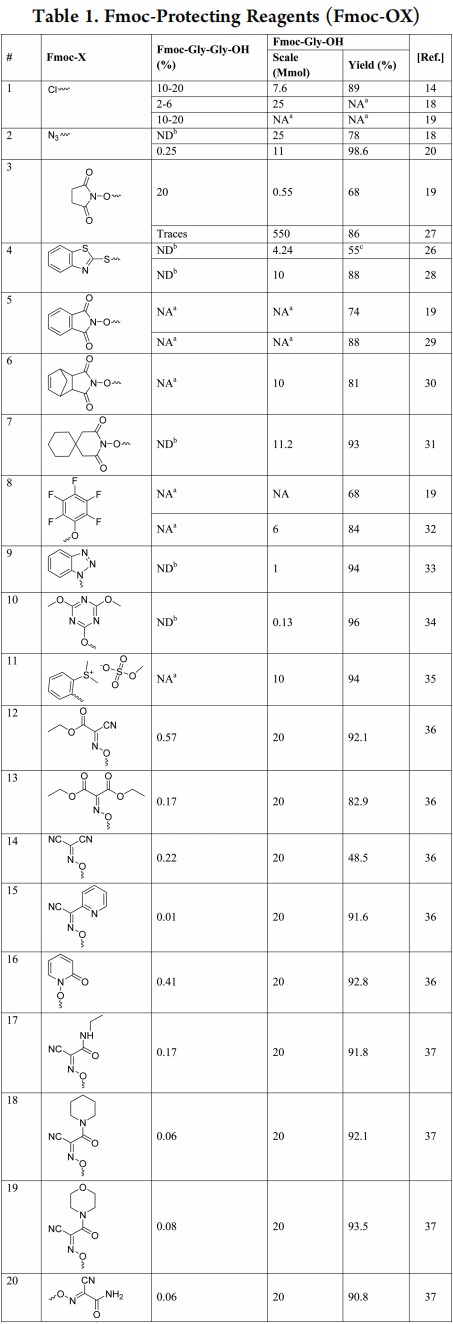
通常与碳二亚胺偶联化合物例如五氟苯基(Pfp)或苯并三唑(Bt)一起使用的其他活性物质,虽然这些试剂价格相对偏高(Pfp)或易爆(Bt)(表1、#8、9),但产率很高,有些实验室甚至研究了Fmoc-三嗪衍生物(表1,#10)作为一种合成Fmoc-氨基酸的方法。对于使用纯水溶液引入Fmoc的方法,已使用Fmoc-苯基二甲基锍甲基硫酸盐 (Fmoc-ODsp),但未研究是否有二肽的形成(表1,#11)。
为了克服肽结构单元合成中的最大挑战之一,即在氨基酸保护过程中不希望形成二肽和三肽,已经深入研究了大量Fmoc离去基团的方法。尽管少量试剂有还不错的结果,但基本没有一种有潜力能应用于工业化生产。在此方面,基于常用的碳二亚胺添加剂肟的结构,提出了Fmoc离去基团衍生物Fmoc-Amox。Fmoc-Amox已用于保护极易产生副反应的H-Gly-OH,有很高的收率 (93%) ,并且完全没有Fmoc-二肽形式的副产物产生,这从 HPLC和NMR分析中得到印证。此外,Amox衍生物将来或许可用于引入其他保护基团,例如pNZ、Alloc和Boc。
Ashish小组认为Oxyma是比碳二亚胺更优秀的添加剂,Oxyma反应性强,在肽的工业化生产中的应用越来越广泛。小组也研究了其他反应性较低的肟衍生物来引入Fmoc基团,从第一次筛选(表1,#12-16)中,包括2-羟基吡啶N-氧化物(HOPO),Oxyma衍生物(表1,#12)由于其高反应性而得到含量较多的二肽,然后是HOPO(表1,#16)。氰基吡啶肟也是较好的添加剂(表1,#15),但其价格昂贵,而且很难从反应中去除。第二次筛选得到的二肽形成量总体较少(表1,#17-20),因此选择氰基酰胺衍生物(Amox)(表1,#20)作为替代 HOSu 以引入Fmoc。Fmoc-Amox价格适宜,并且在反应后可以很容易地去除,这与MBT的情况不同,Amox 在水中的溶解度为0.9 M,这确保了它不会污染最终的Fmoc-氨基酸(表1,#4)。
在Fmoc-二肽形成方面,H-Gly-OH被证明是评估Fmoc-Amox性能的最佳试剂,因为其低空间位阻有利于高比例的寡聚化。使用1克和40克两种平行实验制备Fmoc-Gly-OH结果接近,反应过程描述如下:将Fmoc-Amox的丙酮溶液缓慢加入到搅拌的H-Gly-OH和碳酸钠水溶液中,通过连续分批添加碳酸钠将反应混合物的pH值保持在9-10。通过TLC以及pH稳定性监测反应(pH的降低作为发生反应的标志)。反应完成后(4小时),除去溶剂,剩余的水层用DCM洗涤,然后加入1N HCl(直到pH<2),得到灰白色沉淀,然后过滤沉淀物并使用乙酸乙酯和正己烷(93%)重结晶,HPLC检测Fmoc-Gly-OH的纯度非常好。由于通过固相技术制备的Fmoc-Gly-Gly-OH会与Fmoc-Gly-OH一起被洗脱出来,表明形成的二肽杂质是难去除的,如图 3所示,色谱图中没有观察到二肽的痕迹(图3)。此外,1H NMR 未显示Amox存在任何污染(图4),这清楚地表明Amox在合成Fmoc氨基酸方面有很大的优势。
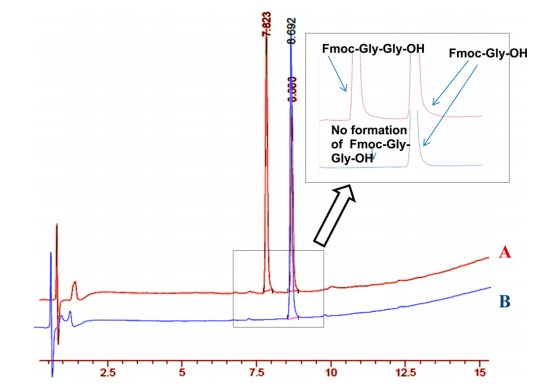
图3 (A) Fmoc-Gly-OH和一同洗脱的Fmoc-Gly-Gly-OH的HPLC色谱图
(B) Fmoc-Gly-OH的HPLC色谱图
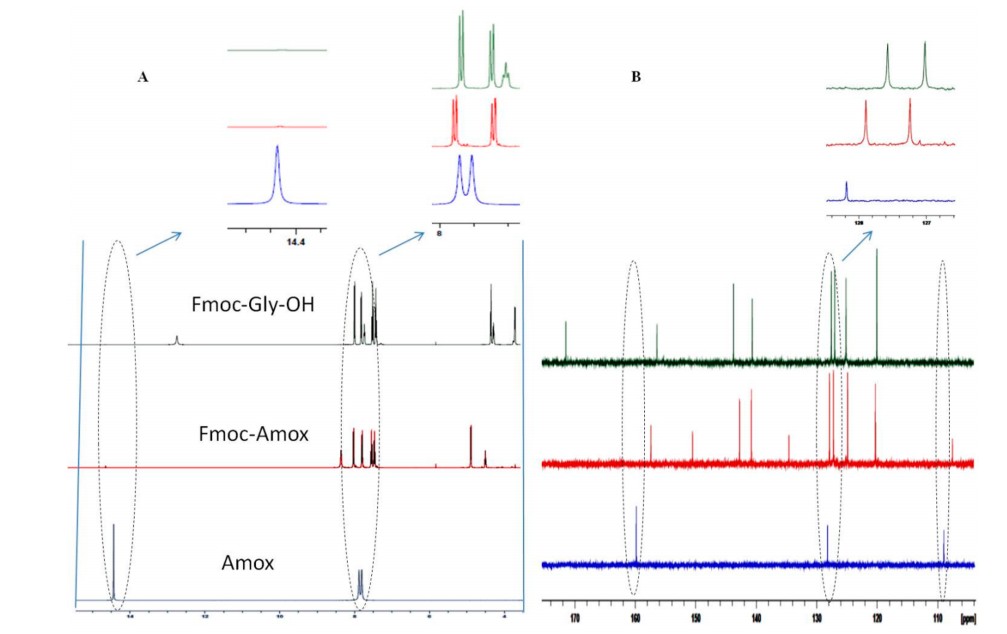
图4 Fmoc-Gly-OH、Fmoc-Amox和Amox的1H和13C NMR比较
在这些结果的推动下,使用上述方法制备了Fmoc-Phe-OH和Fmoc-Val-OH(各10 g小试)(图5和6)。最终产物的纯度通过HPLC和NMR确认,没有显示二肽的微量形成。还研究了溶剂在后处理过程中的重要性,将所得产物溶解在DCM中并使用蒸馏水萃取,DCM后处理有助于去除微量的Amox,从而产生经NMR证实的纯品(图 7)。
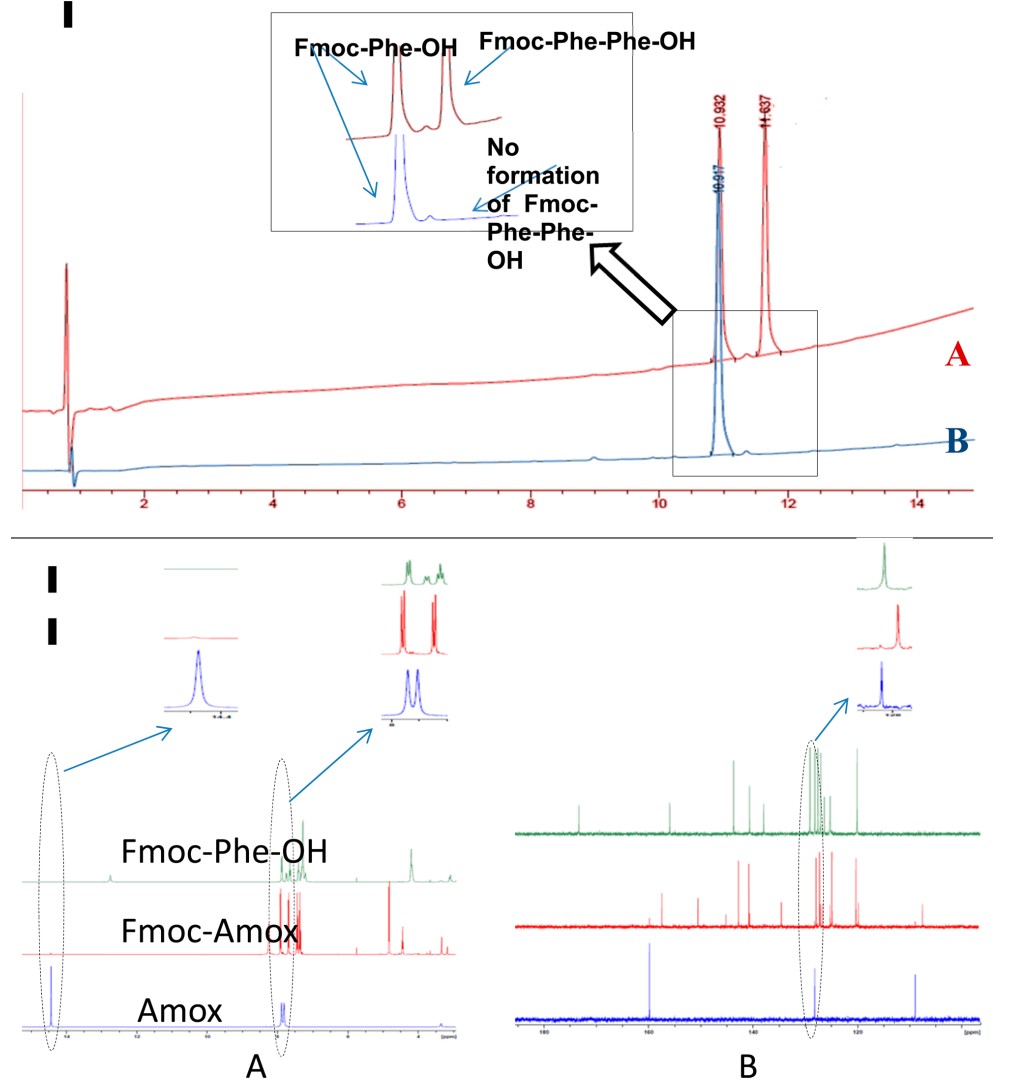
图5 (I)A. Fmoc-Phe-OH与Fmoc-Phe-Phe-OH一同洗脱的HPLC色谱图
B. Fmoc-Phe-OH的 HPLC色谱图
(II) Fmoc-Phe-OH、Fmoc-Amox和Amox的1H和13C NMR比较
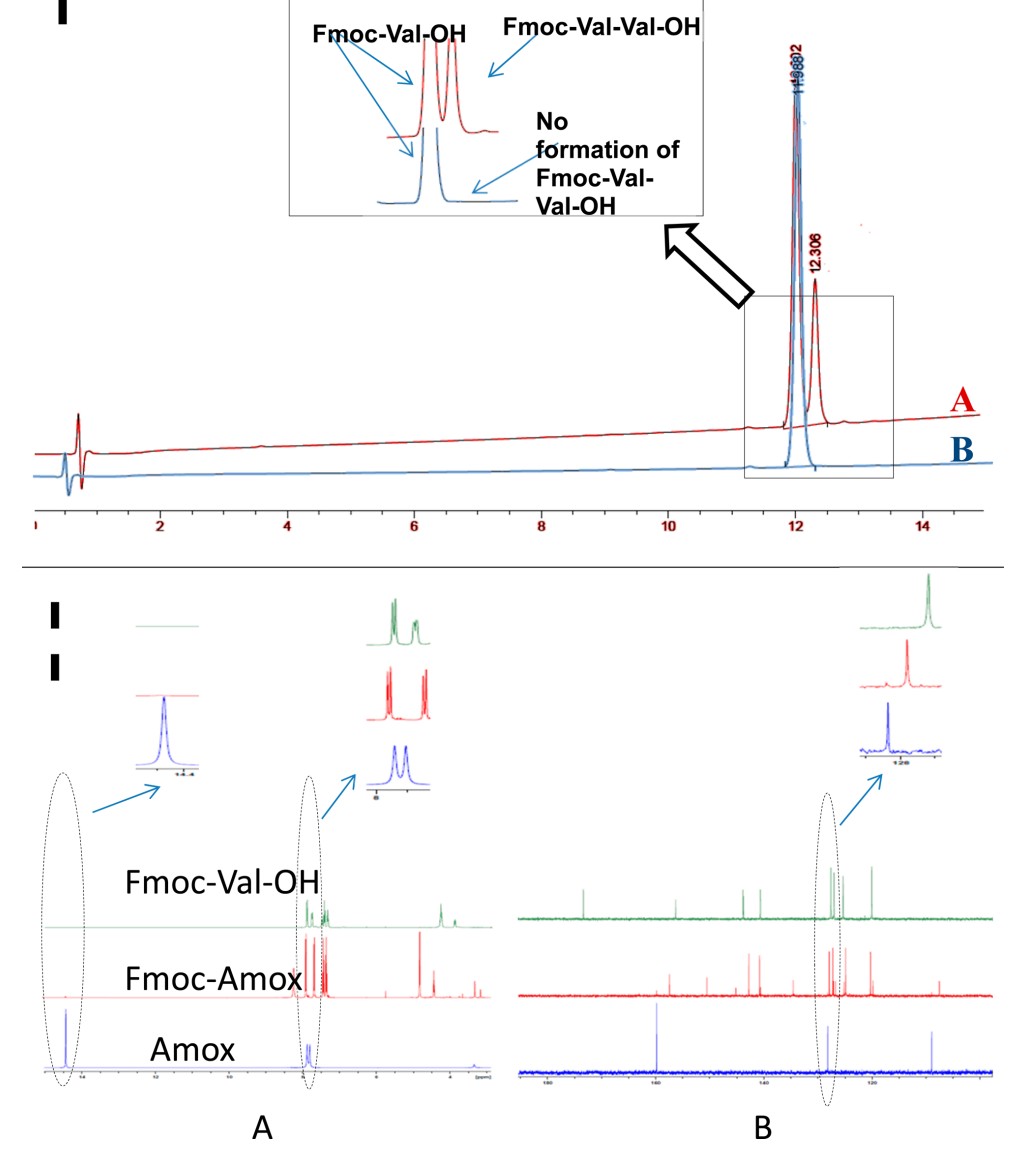
图6 (I) A. Fmoc-Val-OH与Fmoc-Val-Val-OH一同洗脱的HPLC色谱图
B. Fmoc-Val-OH的 HPLC色谱图
(II) Fmoc-Val-OH、Fmoc-Amox和Amox的1H和13C NMR比较
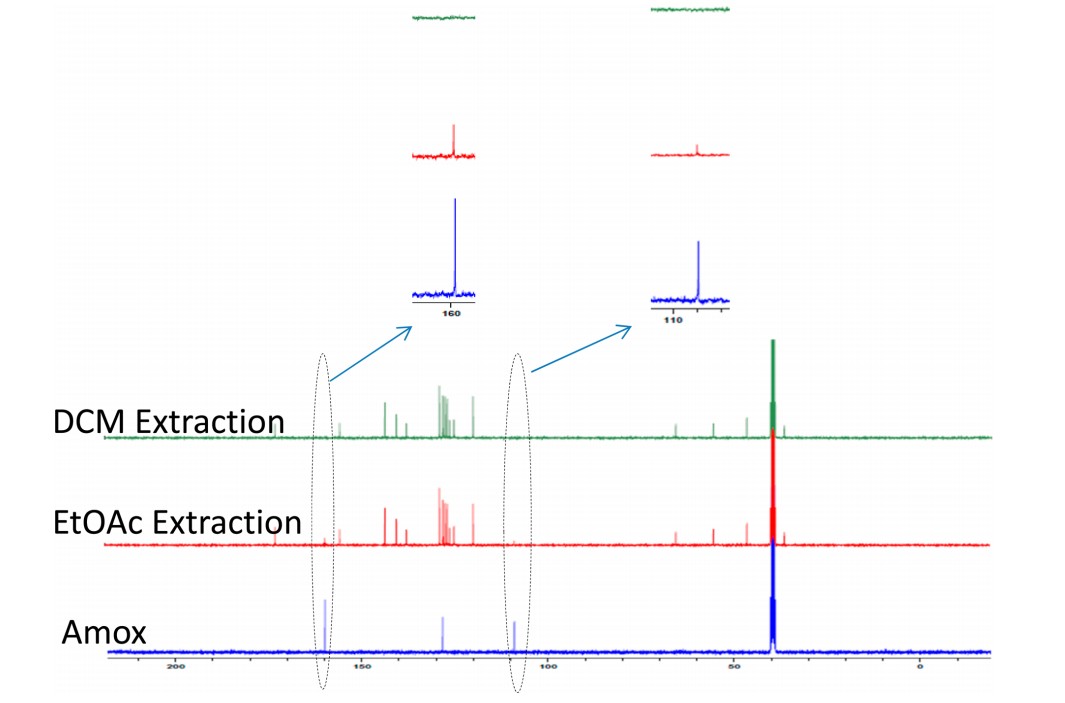
图7 使用乙酸乙酯和DCM萃取Fmoc-Phe-OH的后处理比较
这些结果清楚地表明了Fmoc-Amox在合成最容易产生副反应的Fmoc-氨基酸方面具有很大的优越性。
Fmoc-氨基酸的合成实例:
1、将甘氨酸(131.34mmol)、碳酸钠(106mmol)加到纯化水中,滴加Fmoc-Amox(119.4mmol)的丙酮溶液,保证反应液pH始终保持在9-10。待TLC检测Fmoc-Amox反应完全,将反应液浓缩去除丙酮后用二氯甲烷萃取除杂,水相用1N HCl调酸,大量白色固体析出,过滤,滤饼用纯化水洗三遍。收集固体用乙酸乙酯/正己烷重结晶,得到高纯度的Fmoc-甘氨酸。
2、将苯丙氨酸或缬氨酸(33mmol)、碳酸钠(75mmol)加到纯化水中,滴加Fmoc-Amox(30mmol)的丙酮溶液,保证反应液pH始终保持在9-10。待TLC检测Fmoc-Amox反应完全,将反应液浓缩去除丙酮后用二氯甲烷萃取除杂,水相用1N HCl调酸,大量白色固体析出,过滤,滤饼用纯化水洗三遍。收集固体用乙酸乙酯/正己烷重结晶,得到高纯度的Fmoc-苯丙氨酸或Fmoc-缬氨酸。
注册送38元的游戏网站自2003年成立以来专注于特色酰胺键构成缩合剂、保护剂领域产品的研发与生产,品种齐全、质量优,欢迎客户选购。更多产品请访问昊帆生物官网。

